
SciELO Brasil USO DA TEORIA DO FUNCIONAL DE DENSIDADE NA ANÁLISE DE SPIN CROSSOVER EM AULAS
Esto implica que el número de electrones desapareados en las configuraciones d8, d9 y d10 del ion metálico es, respectivamente, 2 como en [Ni(H2O)6]2+, 1 como en [Cu(H2O)6]2+ y 0 como en [Zn(H2O)6]2+. - La energía de desdoblamiento del campo cristalino (Δo) depende de tres factores: la carga del ion metálico, el número cuántico principal.

Stick view of 2D layer structure of [Co(H2O)6]3[TeMo6O24] stacked in an... Download Scientific
Holleman/Wiberg states (translation by me) $\ce{Co^{3+}}$ usually forms octahedral low-spin complexes, because it is the only way to achieve a high ligand-field stabilization energy. Octahedral high-spin complexes are typically an exception; they are formed with the "weakest" ligands (fluoride): $\ce{[CoF6]^{3-}}$, $\ce{[CoF3(H2O)3]}$ (the ion $\ce{[Co(H2O)6]^{3+}}$ is in the low-spin state).
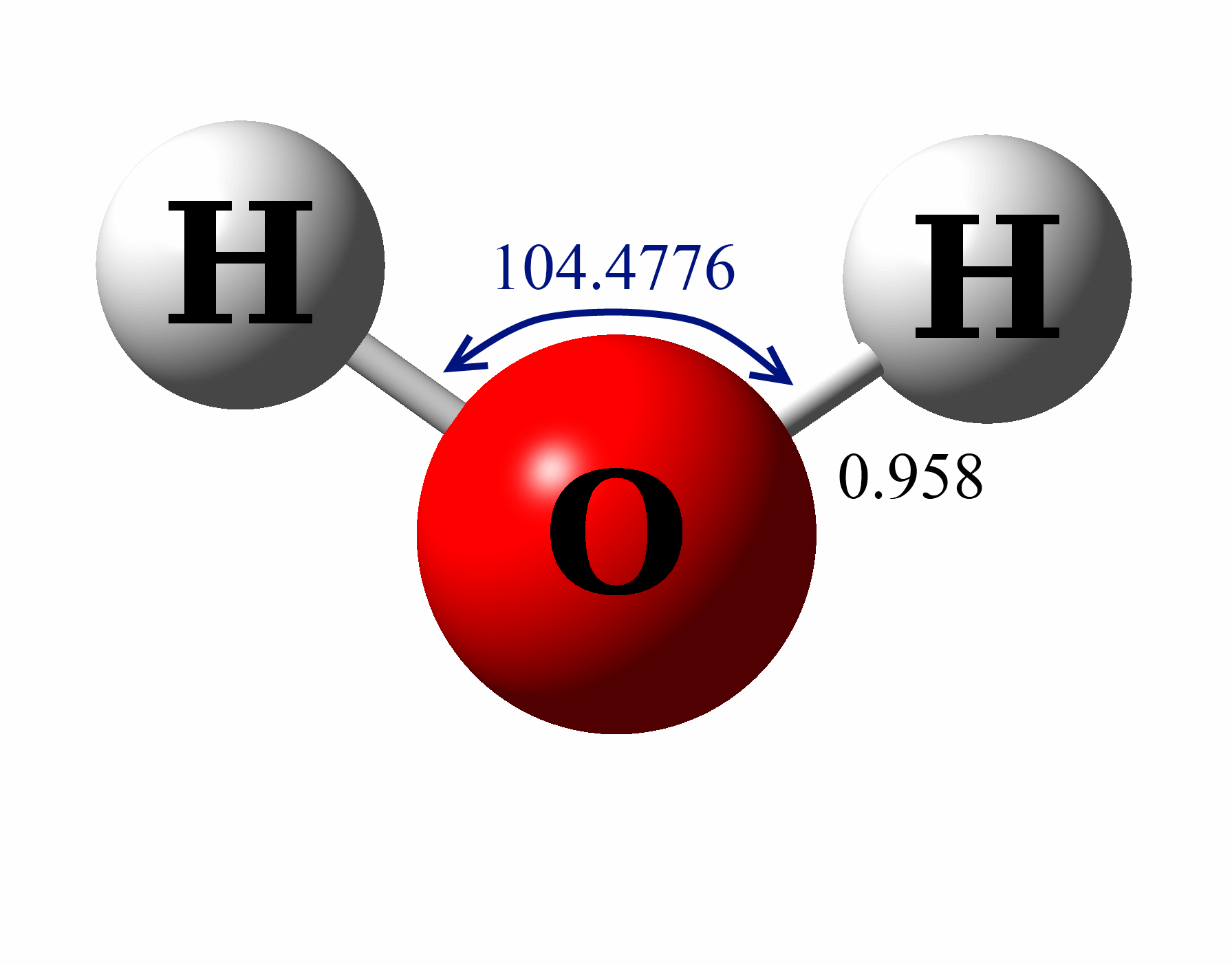
Estrutura De Lewis H2o ENSINO
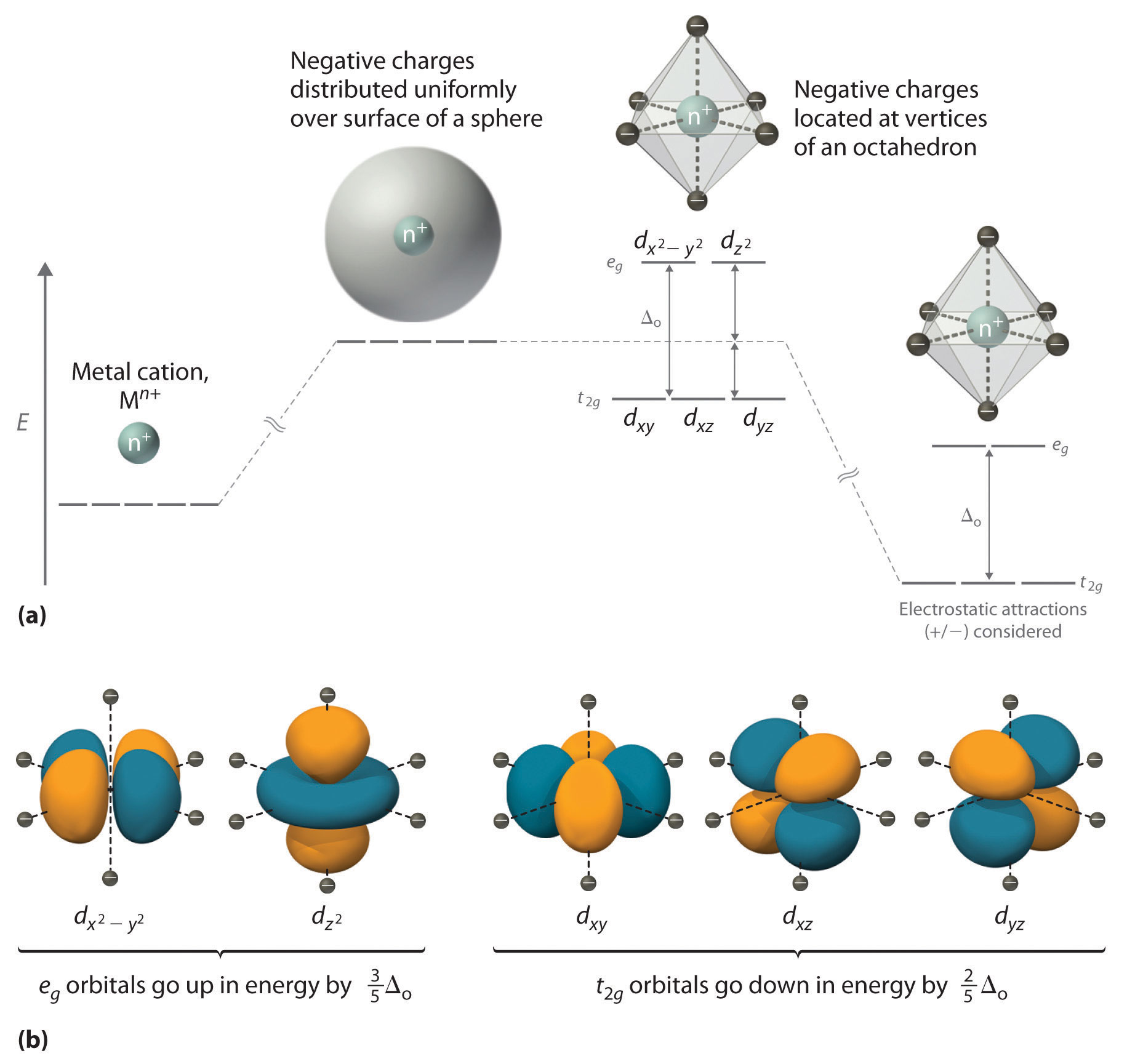
Tema 4: El enlace en los compuestos de Coordinación (I) 2.1.- Campo cristalino en un entorno octaédrico-El campo generado por 6L en simetría Oh no afecta a los 5 orbitales d por igual:-Los orbitales dz2 y dx2-y2 apuntan hacia los ligandos se desestabilizan-dxy, dxz y dyz se orientan hacia las zonas de mínima repulsión se estabilizan - Si el campo fuera esférico, los p.e.
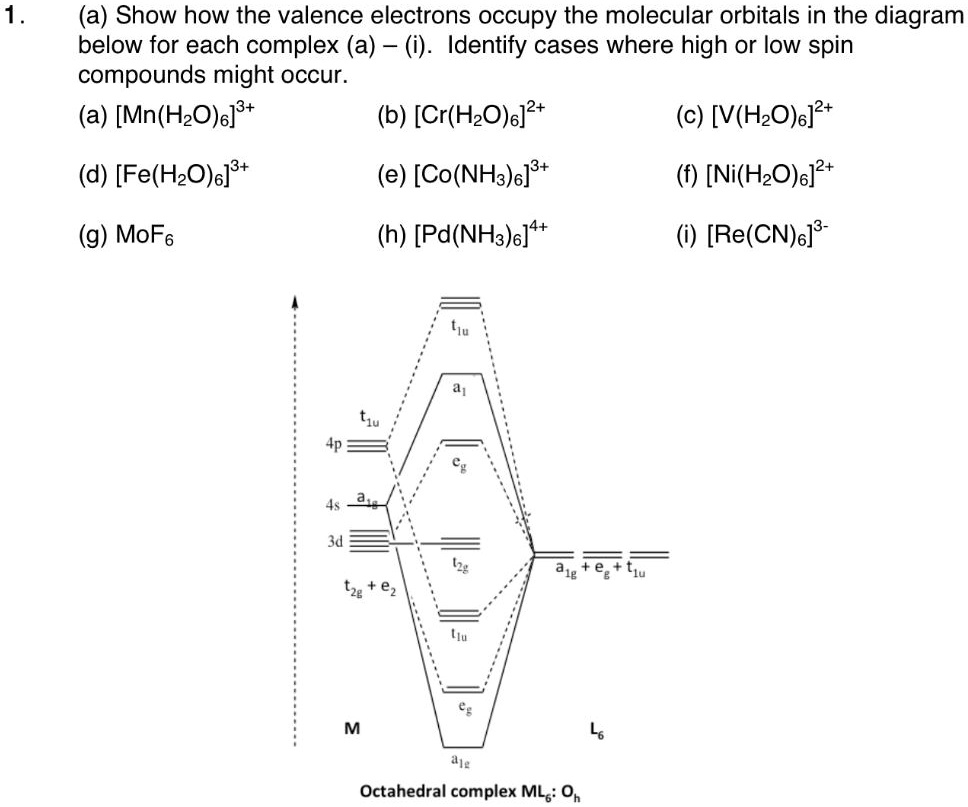
SOLVED Show how the valence electrons occupy the molecular orbitals in the diagram below for
Tomando como ejemplo un complejo de alto spin, por ejemplo un d 4 (t 3 2g e 1 g), el cuarto electrón d puede ocupar el orbital dx²-y² o el dz² con igual energía. Si el orbital d x²-y² está ocupado, se rechazan los 4 ligandos ecuatoriales, lo que da como resultado la compresión del octaedro.

Molecular orbitals diagrams of [Ti(H2O)6]3+
This is a very narrow viewpoint and leads to lots of mistakes: for example $\ce{[Co(H2O)6]^3+}$ is low-spin although $\ce{H2O}$ is fairly low on the spectrochemical series. In truth it depends on (at least) the ligand, the metal, as well as the oxidation state, and there is no magic formula or rule that allows you to combine all three factors.
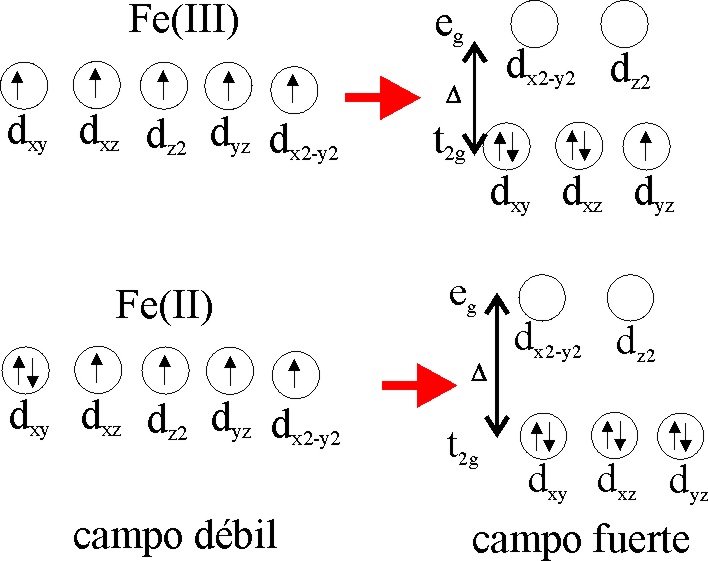
crisis apertura duda configuracion electronica de hierro Grafico perturbación réplica
Bearing four acetate groups (π-donor ligands) and two amino groups ( σ-donor only ligands) we would expect EDTA to form high-spin complexes with M 2+ and M 3+ metals of the first transition series. However, in the case of Co (III) we would expect a low-spin complex. For metals of the second and third transition series, we would expect.

Complejo de cobalto II y principio de Le Châtelier YouTube
para los siguientes iones complejos de cromo:! complejo [CrF6]3- [Cr(H2O)6]3+ [CrF6]2- 3[Cr(CN)6] - Δ0 (cm-1) 15000 17400 22000 26600 Ejercicios Tema 7. Química de Coordinación • Solución:!! III3 complejos de Cr y 1 complejo de CrIV!! IIIi) Complejos de Cr :! - Los valores de Δ 0 están de acuerdo con lo esperado, teniendo en cuenta la

Coordinación química compleja química compuesto octaédrico geometría molecular isómero, óxido de
Equilibrio de espín. El equilibrio de espín se puede dar en un sistema extendido, cuando son posibles dos fases magnéticas. Típicamente, el momento magnético lo aportan metales de transición. Según su población electrónica, algunos metales de transición pueden presentar estado de alto espín o de bajo espín, y se encuentran en uno u.

EPR del complejo de Co. Download Scientific Diagram
degenerados, se desdoblan en dos grupos: d y d. x2-y2 z2. (alta energía) dxy, dxz, d. yz (baja energía) electrones d, esto conduce a 2 llamados alto spin-bajo spin o fuerte. El gap de energía depende ligandos. complejos d6 Co(III), pueden octaedrales y de BAJO spin, p.e. t 2g 6. Comparación de momentos magnéticos calculados (sólo spin.

(PDF) Electron spin relaxation of vibronic Cu(H2O)6 complexes in K2Zn(SO4)2·6H2O single crystals
Teoría del campo cristalino. La teoría de campo cristalino (TCC) es un modelo teórico que describe la estructura electrónica de aquellos compuestos de los metales de transición que pueden ser considerados compuestos de coordinación. La teoría de campo cristalino explica exitosamente algunas de las propiedades magnéticas, colores.

[Resuelta] compuestosdecoordinación 18 Regla de los
6] 2+. La adición de ligandos a la disolución acuosa permite la formación de complejos por el sucesivo desplazamiento de moléculas de agua. En el caso del amoniaco, por ejemplo, las moléculas de NH 3 desplazan a moléculas de agua hasta formar [Cu(NH 3) 4 (H 2 O) 2] 2+, pero la adición de la quinta y sexta moléculas de NH 3 no se produce

High Spin and Low Spin Complexes
Ejemplos de complejos de espín alto y bajo: [Co (H 2 O) 6 2+] contiene un ión metálico d 7 con un ligando de campo débil. Se sabe que este complejo es de alto espín a partir de mediciones de susceptibilidad magnética, que detectan tres electrones desapareados por molécula. Su ocupación orbital es de (t 2g) 5 (e g) 2.
High Spin and Low Spin Complexes Chemistry LibreTexts
Universitat de València

44. Compuestos de Coordinación Escribir el nombre del complejo [Cr(H2O)6]Cl3 Según la IUPAC
Comprender cómo la teoría del campo cristalino explica las estructuras electrónicas y los colores de los complejos metálicos. Una de las características más llamativas de los complejos de metales de transición es la amplia gama de colores que exhiben (Figura 23.4 y Figura 23.5). En esta sección, describimos la teoría del campo.
modelo de química de la molécula de agua h2o elementos científicos. partículas integradas de
Síntesis de los complejos [Co(H₂O)(NH₃)₅]Cl₃, [CoCl(NH₃)₅]Cl₂, [Co(κO-NO₂)(NH₃)₅]Cl₂ y [Co(κN-NO₂)(NH₃)₅]Cl₂. Material.. (III) son de bajo spin y diamagnéticos, dado su alto estado de oxidación (indica campo fuerte). Se comprobará mediante medidas espectroscópicas en la franja del (VIS-UV) que realmente.

Is H2O Ionic or Covalent? Techiescientist
Los tres electrones se llenarían spin-up en el orbital t 2g siguiendo la regla de Hund (Figura \(\PageIndex{4}\)). Debido a que cada electrón tiene el espín +1/2, el espín total de los tres electrones es 3x1/2=3/2.. Para el complejo de alto espín no existe otro término sexteto, lo que significa que no hay transición electrónica.
- Botas De Futbol 2017 Messi
- Zapatillas Estar En Casa Verano
- Se Puede Grabar Dos Partidas Pokemon Esmeralda
- Cuanto Gana Control De Calidad
- Reloj De Arena De Aceite
- Global Process Owner Organization Chart
- Cheka Si Tu Te Vas
- Convencion Barcelona 12 05 2018 Nh Hotel
- Lexus Is 300 Hybrido Automatico
- Vaso De Plastico Medio Litro